From PGI
Contents
포도상구균의 인수공통성 감염연구에 NGS를 이용하면?
최근 메티실린에 저항성을 가지는mecC(mecA homologue)와 상동성을 갖는 새로운 mecA를 운반하는 MRSA가 덴마크의 저수지 근처에서 발견되었다. 이는 인수공통성 감염으로, 2명의 사람은 각각 다른 농장에서 근무하면서mecC-MRSA에 감염되어 있었다. 영국의 케임브릿지 대학의 수의학과 연구진들은 일루미나 HiSeq 플랫폼을 이용하여 전장게놈을 해독(Whole Genome Sequencing)하였고, MRSA의 분자역학을 조사할 수 있었다.
단일 염기 변이를 확인하기 위해 참조게놈과 비교하였으며, 크게 두 가지 단일 변이 그룹을 발견하여 사람과 가축의 구분이 있는 것을 확인하였다. 2개의 다른 농장에서 다른 결과를 보였다. 한 명은 기르는 가축과 멀리 떨어져서 분리되어 있었으나 감염되었고, 또 다른 한 명은 기르는 가축과 같은 곳에서 생활하면서 동시 감염이 이루어졌다. 이를 통해 인수공통의 감염인자 가능성을 확인하였다. 또한 추가적으로 감염 균의 숙주와의 상호작용과 유독성에 연관된 많은 유전 변이들을 동정하였다.
본 연구는 mecC-MRSA ST130를 분리해내어 사람과 동물 사이의 감염이 가능한 것을 확인하는 실험이였고, 세균성 감염과 유행병의 역추적 조사에서 전장 게놈의 해독이 필요하다는 것을 뒷받침하였다.
그림 1 Staphylococcus aureus(MRSA)
메틸실린에 저항성을 가지는 황색 포도상구균은 피부감염, 폐렴, 심막내염을 포함하여 감염 범위가 넓다. 적은 수의 MLST(Multi Locus Sequence Typing)가 아시아(ST23G)와 남부 아메리카(ST8) 샘플을 포함하여 전세계 다른 종과 유사하다는 것을 확인하였다. 특히 MRSA ST398 종의 출현은 포도상구균의 인수공통성 감염의 대표적인 모델이 되었으며, 사람과 가축 사이에서는 최근 mecC가 homologue된 mecA가 덴마크 사람에게서 발견되었다.
mecC는 페니실린이 부착된 단백질에 위치한다는 점이 세폭시틴에서 유사하게 나타났지만, mecA와는 감수성에서 차이가 나타났다. 또한 mecC 양성 반응의 MRSA를 분리하여 mecC와 mecA 분기시기를 확인하고, PCR과 분석을 통해 mecA와 PBP2a를 감지하였다. 뿐만 아니라, 소와 지리적으로 근접한 인간에게서 나타나는 감염과의 유사성을 밝혔다.
최근 연구에서는 인간에서 발견된 mecC는 유럽 전역의 동물들에게서 발견된 것과 유사하게 나타났으며, mecC-MRSA의 발병률이 증가하여 임상 및 분자 역학적으로 중요한 가치가 되었다.
mecC-MRSA 감염 사례
덴마크인의 mecC-MRSA 감염에서 두 환자는 각각 농장에서 일하였기 때문에, 가축과 연관성이 있었다. 하지만 두 농장에서 채취한 각각의 샘플들은 다음의 분석과정을 거쳤다. ST130은 MLST를, T843은 spa typing을, MT429는 PFGE(pulsed-field gel electrophoresis)과 MLVA(multilocus variable number tandem repeat analysis)를 이용하여 구별하였다.
전장 게놈 해독을 이용하여 분자역학적 감염을 조사하였는데, 농장의 특성상 사람과 동물간의 매개 전송을 지원하는 지 여부에 따라 단일 염기 변이의 차이를 보였다. 즉, 사람의 MRSA 감염에서 가축의 역할이 중요하였다.
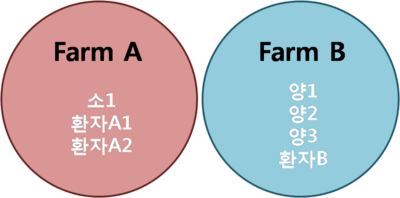
그림 2 사람과 가축의 계통 발생 연관성
첫 번째 53세 여성 환자(A)에서는 코에서 채취한 mecC-MRSA를 분리하였다. 환자A는 심한 어깨 통증과 발열이 지속되고, 혈액 CRP(C-반응성 단백질)의 감소 증상이 있었다. 두 번째 환자는 69세 여성 환자(B)로 혈액에서 mecC-MRSA를 분리하였다. 환자B는 근육과 동맥이 절단되는 팔 수술이 있었으며, 이로 인해 약간의 상처가 있었다.
환자 A와 B의 농장은 서로 45km(28mile) 떨어져 있었으며, 환자A의 농장에는 2마리의 소, 2마리의 말, 1마리의 개가 있었고, 환자B의 농장에는 10마리의 양이 있었다. 가축 샘플은 환자 A의 농장에서 13.5개월 된 소에서 mecC-MRSA를 분리하였다. 두 농장으로부터 분리한 샘플은 여러 가지 분석 방법을 이용하여 미생물에 저항성을 가진다는 사실을 발견하였으며, 특히 세폭티딘과 페니실린에 내성을 가졌다는 사실을 발견하였다.
가축으로부터 감염되었다는 사실을 확인하기 위해 두 환자의 전장 게놈을 해독하였으며, 핵 게놈의 단일 변이를 이용하여 확인하였다. 그 결과 3가지 가축들에서 유사한 연관성을 보였으며, 단지 154개의 단일 변이 차이만이 확인되었다. [그림 2]에서 보여지는 계통발생은 같은 농장에서 채취된 사람과 가축의 단일 변이가 104개 차이가 발생하여, 2개의 그룹으로 분리된 것이다.
[그림 2]는 A환자의 농장에서 환자와 소 1마리, B환자의 농장에서 환자와 양 3마리에서 분리한 균을 분리한 것이다. 환자 A는 코에서 채취한 샘플을 이용하였고, 차별화되는 단일 변이가 발견되지 않았지만, 소와는 5개의 단일 변이가 발견되었다. 그러나 단일 변이에 의해 전염이 일어났으며, 전염 경로를 확인할 수 없었다. 환자 B는 양1과 5개, 양2와 3개의 단일 변이 차이가 보였으며, 양3과는 40~42개의 단일 변이 차이를 보였다. 양의 균주 간 다양성은 오랜 시간 무리에서 순환 감염에 의한 것으로, 단일 변이의 수가 축적되는 것을 방지하기 위해, 인체 감염 이전에 양 간의 순환 감염이 이루어진 샘플을 이용하였다. 따라서 환자B는 감염경로가 양에서 사람이다.
감염 균의 숙주와의 상호작용과 유독성에 연관된 많은 유전 변이들
비교 게놈을 통해 이동성 유전자를 조사하여, 균의 다양성을 평가하였다. 2가지 분기 그룹의 이동성 유전자가 mecC-MRSA ST425 내 25kb 파지를 포함한다는 점을 제외하고는 유사하였다(양3에서는 다른 양들에 비해 wSa8 파지가 적다). 또한 mecC-MRSA ST130 균주의 인수공통 감염적 성향을 이해와 포도상구균의 독성에 대한 게놈 서열을 분석하였다.
잠재적인 숙주와의 상호작용과 연관된 모든 단일 변이를 식별하고, 그 위치를 파악하였다. 총 154개의 단일 변이로 균주를 구별하였으며, ST239 균주에서는 84개의 non-synonymous 변이와 25개의 synonymous 변이, 45개의 유전자간 변이가 발견되었다.
14개의 유전자리 중 11개가 종결코돈으로 발현되는 단일 변이를 유도하였다. 환자B의 농장에서 채취된 4가지 샘플은 조기 종결되는 Ile369Stop 변이로 인해, 면역 시스템에 영향을 끼쳤다. 또한 독성과 항생제 내성에 관련된 유전자에서 2개의 염기가 제거되는 것을 확인하였다. 하나는 모든 균주에서 콜라겐에 접착된 유전자의 감염 범위인 3.3kb가 제거되었으며, 다른 하나는 모든 균주에서 EamA와 같은 전이성 단백질 norG, 내성 조절인자 영역의 2.3kb가 제거되었다.
전장 게놈 해독에 의해 mecC-MRSA ST130 샘플에서 조기 종결코돈의 원인이 되는 단일 염기 변이를 나타낸 것으로, 인수공통 감염의 증거를 시사한다. 단일 염기 변이 데이터가 감염 방향의 명확한 증거를 제공하지는 않지만, 일방적으로 동물에서 분리되어 인간에게 감염된 CC130 샘플의 발견은 가능성을 제시하였다.
유전자의 이질성을 평가하기 위해 동일한 숙주에서 여러 차례 균을 분리하였으며, 인수공통의 감염 증거를 조사하기 위해, 각 숙주에서 여러 가지 부위를 샘플링하였다. 또한 숙주 특이성과 독성 및 항생제 내성과 관련된 유전자 결실을 확인하였다.
양에 관련된 균주는 면역 글로불린의 결합 단백질인 Sbi를 결합시키지 못하여, 면역 시스템에 문제가 생겨, B-lactams에 norG 저항성을 확인하였고, 포도상구균 감염에 의한 질병에서 진보된 유전자 변이와 독성의 전사를 조절하여 조기 종결코돈에 영향을 끼치는 ARAc 그룹을 확인하였다.
맺음말
사람과 동물 사이의 감염성 확산과 포도상구균의 병원체 진화를 이해하기 위해, 분리된 숙주와의 균 게놈 해독이 중요하다. 본 연구에서 mecC-MRSA의 분리와 인수공통 감염 경로를 확인하기 위해, 전장 게놈 해독 기술을 이용하여 확인한 첫 번째 사례이다. 병원에서 임상 역학적 추적 도구로서의 게놈 해독 기술의 가치를 입증한 것이다.
참고문헌
Whole genome sequencing identifies zoonotic transmission of MRSA isolates with the novel mecA homologue mecC.
Staphylococcus aureus leucocidin ED contributes to systemic infection by targeting neutrophils and promoting bacterial growth in vivo.
Livestock-associated Staphylococcus aureus: origin, evolution and public health threat.
http://wwwnc.cdc.gov/eid/article/18/11/11-1850_article.htm
역저자
글 : Jung.SoYi
편집 : Park.HyeonJi, Lee.Hyungki
키워드 : Staphylococcus aureus(MRSA), mecC(mecA homologue), Whole Genome Sequencing, cefoxitin, MLST(Multi Locus Sequence Typing) 등