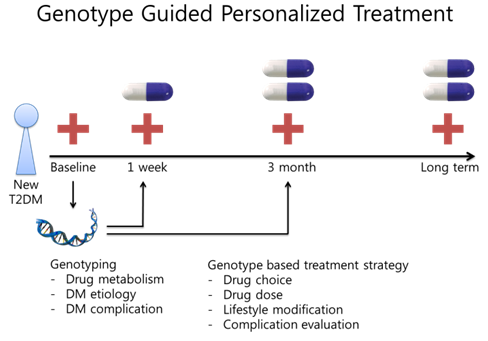From PGI
Contents
당뇨병의 약물유전체학(pharmacogenomics)과 개인 맞춤형 의료(personalized medicine)
최형진
- 유전형 기반 개인 맞춤형 의료(genotype based personalized medicine)
필자가 진료를 담당하고 있는 내분비내과는 특히 약물적 치료법에 많이 의지하고 있는 진료분야이다. 같은 약을 사용하여도, 어떤 환자들은 약물로 그 질병이 치료가 잘되고, 어떤 환자들은 반응이 없거나, 부작용이 심한 경우들이 있다. 따라서, 특정 약물이 잘 반응할 환자군을 미리 알 수 있거나, 심각한 부작용이 발생할 위험이 높은 환자군을 미리 알 수 있다면, 진료에 있어서 환자에게 큰 도움을 줄 수 있다.
이런 환자 개별 특징에 맞춰 다르게 진료하는 접근을 개인 맞춤형 의료(personalized or prevision medicine)이라고 하며, 이는 기존의 근거 기반 가이드라인(evidence based guideline)의 일괄적인 의료(guideline based medicine)와 상반된 철학적인 접근이다. 이런 의료에 대한 두 가지 철학적 접근의 장점들을 살리기 위해 최근 임상진료지침들은 다양한 임상적 지표들(나이 등)에 따라, 치료 반응이나, 부작용 위험을 고려해서 치료하도록 지시하고 있다. 여기서 더 나아가, 환자의 유전형에 따라 특정 약물의 반응 효과나 부작용 위험이 차이가 나는 특정 유전변이를 안다면, 유전형 기반 개인맞춤형 의료가(genotype based personalized medicine) 가능하게 된다.
- 약물유전체학(Pharmacogenomics)에 대한 기대
이와 같은 약물 유전체 연구가 최근 큰 관심을 받고 있는 중요한 이유 중 하나는, 기존의 질병 발병 위험율(susceptibility) 관련 유전변이들의 영향력이 작았던(small effect size) 것에 비해, 약물유전체의 유전변이들은 임상적인 결과에 미치는 영향력이 강력할 수(large effect size) 있기 때문이다. 질병 발병 위험률 관련 유전변이들은, 여러 세대를 내려오면서 음성선택(negative selection)되어서 흔한(common) 강력한 효과를 보이는(large effect size) 유전변이는 거의 남아있지 않게 되는 것에 비하여, 약물 반응/부작용과 관련된 유전변이들(pharmacogenetic markers)은 이와 같은 음성선택이 거의 없었기에(지금까지 약에 노출되지 않았다), 약물 반응/부작용을 비교적 강력하게 예측하는 흔한 유전변이들이 이론적으로 많이 존재할 수 있다. 따라서, 유전체의학의 측면에서 활용가능성이 높은 중요한 유전변이들을, 이런 약물유전체 분야에서는 발굴할 수 있을 것으로 많은 사람들이 기대하고 있다.
이미 미국 식약청(FDA)에서는 119개나 되는 약물과 약물유전체 바이오마커 리스트를 승인하여 약물 라벨에 표시하게 하고 있다(2013년3월 기준; http://www.fda.gov). 이런 약물유전체 바이오마커들은 약물의 효능 차이, 부작용 위험도의 차이, 유전형에 따른 최적 용량, 약물작용기전 등의 측면에서 진료에 활용될 수 있다. 이와 같이 이미 약물유전체학은 환자 진료에 적용되고 있으며, 이와 같은 약물과 약물유전체 바이오마커 리스트를 빠르게 그 숫자가 증가하고 있다.
이와 같이 약물유전체학은 유전체의학 분야 중에서도 가장 빠르게 진료에 적용되고 있으며, 앞으로도 그 활용도에서 가장 기대되는 분야이다. 암과 관련해서는 종양의 돌연변이(somatic mutation)을 기반으로 하는 약물유전체학이 표적치료(targeted therapy)과 함께 활발하게 연구되고 있다. 당뇨병과 같은 만성 질환에 대한 약물유전체학은, 부모에게 물려 받은 유전형(germline genotype)을 기반으로 암 관련 약물유전체학과는 약간은 다른 접근이 이루어 지고 있다. 다양한 약물유전체학의 활용범위 중에서 이번 글에서는 당뇨병 유전체 의학 분야에서 약물유전체학이 어떻게 연구되고 있으며 활용될 수 있을지를 이야기해 보고자 한다.
- 당뇨병 약물유전체학 연구
가장 많이 사용되고 있는 당뇨병약은 metformin이다. Metformin의 체내 대사 과정을(pharmacokinetics) 관여하는 유전자들을 대상으로 하는 candidate gene approach의 약물유전체 연구들이 많이 시행되었다. 이런 연구들에서 OCT1(SLC22A1)의 rs622342와 MATE1(SLC47A1)의 rs2289669 등의 SNP들이 metformin의 당뇨병 치료효과와 연관되어 있는 것으로 보고 되었다. 이 2가지 SNP의 조합에 따라, 가장 효과가 좋은 환자군에 비해 가장 효과가 좋지 않은 환자군은, metformin의 치료효과 차이가 HbA1c 검사 결과 수치로 절대값 1.5 % 차이가 생긴다고 보고 되었다. 대부분의 당뇨병약제의 치료효과가 HbA1c 수치를 절대값 0.5-1.5% 정도 낮추는 것이라는 점을 고려한다면, 이런 유전형에 따른 metformin 치료 효과 차이의 크기는 상당히 임상적으로 중요한 정도의 크기라고 (당뇨병약제 한가지를 추가로 사용하지 않아도 되는 정도) 할 수 있다.
또한 metformin의 약물 효능의 사람간의 차이를 결정하는 SNP 를 발굴하려는 GWAS 연구가 2011년 Nature Genetics에 발표되었다. 이 연구에서 ataxia telangiectasia mutated gene(ATM) 유전자의 rs11212617 SNP가 metformin의 당뇨병 치료 효과와 연관되어 있는 것으로 보고되었으며, 2012년 Diabetologia 에 발표된 논문을 통해 다른 당뇨병환자 코호트에서도 이와 같은 ATM 유전자 SNP와 metformin의 당뇨병 치료 효과와의 연관성이 재현되어 확인되었다. 이외에도 많이 사용되고 있는 sulfonylurea, glinide, TZD 등에 대해서도 다양한 SNP 들이 약물치료 효과에 영향을 주는 것으로 발표되었으나, 아직까지 metformin 보다는 연구가 부족한 현실이다. 또한 최근 많이 사용하고 있는 당뇨병 신약 DPP4 inhibitor 약제들에 대해서도, 그 효능과 부작용에 대해, 임상적으로 유의한 차이를 만들 수 있는 약물유전체 마커들을 발굴하여, 상대적으로 고가인 이런 약제들에 대한 최적의 환자군을 선별하여 치료하는 유전형기반 개인 맞춤형 의료가 필요하다는 임상적 요구들이 있다.
- 당뇨병 약물유전체학 연구의 2가지 방향
이런 당뇨병 약물유전체학 연구는 크게 2가지 방향으로 분류될 수 있다고 생각한다. 첫번째 방향으로는 유용한 약물유전체학 마커의 발굴을 위한 연구가 있고, 두번째 방향으로는 그 유용성이 입증된 약물유전체학 마커들을 실제 진료에 적용하여 임상적 유용성을 입증하는 방향이 있다.
1. 당뇨병 약물유전체학 마커 발굴 연구 – 코호트 기반 후향적 연구
첫번째 방향인 당뇨병 약물유전체학 마커 발굴을 위해서는, 상당한 수의 당뇨병 환자 코호트들과 약물 시작 전후의 임상정보가 필요하다. 서양인에서 발견된 마커는 대부분 원인변이(causal variant)가 아니고 표지유전변이(marker variant)이기 때문에, 우리나라 사람에게 그대로 서양인에서 발견된 표지유전변이를 적용하는 것은 위험하다(LD structure 차이, 변이 빈도 차이 등 이유).따라서, 약물유전체학 마커들을 우리나라 환자로 구성되어 있는 코호트를 통해, 기존의 서양인 코호트에서 발굴한 마커를 재확인하거나, 아니면, 우리나라에 특이한 약물유전체학 마커들을 발굴할 필요가 있다. 이를 위해서는 상당 규모의 코호트들로 구성된 한국인 당뇨병 유전체학 환자 코호트와 공동연구를 할 수 있는 컨소시엄이 필요하다.
이런 코호트들에서, 당뇨병 환자들의 당뇨병약제 사용 정보, 혈당 조절 효능 정보, 부작용 정보, 합병증 발병 등 임상적 중요 표현형들을 정리하고, 환자 DNA 에서 candidate gene 들을 sequencing 하거나, genotyping 하거나, 전장유전체를 대상으로 SNP chip 이나 sequencing 하는 방법을 통해 유전형 정보를 확보하여, 이 둘 사이의 연관성을 분석하는 방법으로 한국인 당뇨병 환자에 대해 특이적이고 최적화된 약물유전체학 마커들을 발굴할 수 있다.
2. 당뇨병 약물유전체학 마커 기반 개인 맞춤형 의료 – 진료실 기반 전향적 연구
그림 1 제2형 당뇨병의 유전형에 따른 개인별맞춤형 진료
두번째 방향인 약물유전체학 마커들을 실제 진료에 적용하는 유전체의학은 다음과 같은 형태로 진료실에서 실행 될 수 있다(그림 1). 당뇨병에 진단되어 처음 진료실에 방문한 시점에 DNA를 확보하여 유전체 검사를 해서, 선정된 중요한 약물유전체학 마커들을 확인한다. 추가적으로 당뇨병 원인(DM etiology), 당뇨병 합병증 발생위험도(DM complication susceptibility)와 관련된 유전자에 대해서도 유전체 검사를 할 수 있다. 1주일 후 환자가 다시 외래에 방문하는 시점에 이와 같은 유전형을 바탕으로 초기 치료 약제의 종류/용량/생활습관/주의사항/합병증 검사 방침 등을 결정한다. 이후 외래 방문 시 약제의 용량이나 용량 변경 등의 과정에도 분석된 유전형을 고려하여 진료방침을 결정한다.
이와 같은 유전형에 따른 개인별맞춤형 진료를 통해서 혈당 조절 정도, 합병증 발생 빈도 등 장기적으로 우수한 임상적 치료 결과를 거둘 수 있는지 확인하여, 유전체의학의 유용성을 입증한다.
- 약제 부작용 관련 약물유전체 연구
약제 사용에서 약간 다른 관점으로 중요한 측면으로, 약제 부작용이 있다. 상당히 흔하고 환자에게 자주 불편을 주는 부작용들(예: metformin에 의한 소화기 부작용)은 진료에 있어 중요한 요소이다. 또한, 많은 약제들이 그 라벨을 살펴보면, 1% 미만의 매우 드문 심각한 부작용(예: 항갑상선제에 의한 무과립구증)에 대한 경고가 명시되어 있다. 이런 부작용들은 드물기에 위험을 감수하고 사용하지만, 이런 부작용이 발생하는 경우 그 환자에 대해서는 치명적일 수 있기에 또 다른 측면의 주의가 필요하다.
필자는 현재 항갑상선제를 사용하다가 희귀하지만 사망에 이를 수도 있는 심각한 약물부작용이 발생한 증례들을 모아서, 이런 심각한 약물부작용과 관련된 유전변이를 발굴하는 소규모 whole exome sequencing 연구 프로젝트를 진행 중에 있다. 이런 연구를 통해, 희귀하지만 사망에 이를 수도 있는 심각한 약물부작용을 예측할 수 있는 유전자검사 방법을 고안할 수 있다면, 이런 약제를 사용하기 전에 간단한 유전자 검사를 통해 부작용 고위험군을 선별하여 다른 약을 사용하거나, 부작용을 빈번하게 모니터 하는 등의 방법으로 환자에게 극적인 도움을 줄 수 있을 것으로 기대하고 있다. 기존의 흔한 변이들을 목표로 하는 연구와 달리, 이런 드문 부작용 발병 위험 변이에 대한 연구는, 환자 정의, 환자 모집, 대조군 모집, 유전형 분석 기술(rare variant, common variant), 통계적 분석 기술, 분석 목표(변이 중심 분석, 유전자 중심 분석) 측면에서, 상당히 다른 접근을 필요로 한다. 이런 “희귀 약물 부작용 발굴 연구”에 대한 학문적인 방법론 확립과 성공적인 연구 수행 노하우 축적을 통해, 다른 약제의 다른 부작용에 대해서도, 효과적으로 연구 방법을 적용할 수 있을 것으로 기대한다.
- 당뇨병약제의 약물유전체 연구 콘소시엄과 기대 효과
우리 충북대 병원에서는 올해 2013년까지 당뇨병환자 코호트를 1400명까지 모집하여 유전자 샘플과 임상정보를 정리할 목표로 당뇨병환자 유전체 코호트를 만들어 가고 있다. 또 동시에 국내 다기관 콘소시엄을 구성하여 당뇨병약제의 약물유전체 연구를 수행하기 위해 Genomic Medicine Interest Group 이라는 공동연구 모임을 기반으로 여러 병원 연구자들과 네트워크를 구축하였다. 이런 협동적인 노력을 통해, 바로 직접적으로 환자를 도울 수 있는 실용적인 translational research 가 가능할 것으로 기대한다.
결국 이런 약물유전체학(pharmacogenomics)과 유전형 기반 개인 맞춤형 의료(genotype based personalized medicine)을 통해 진료실이 발전하게 되면, 각 환자에게 최적의 당뇨병약제를 선별할 수 있고, 이를 통해 당뇨병합병증(뇌경색, 심근경색, 하지절단, 실명, 말기신부전, 사망)을 효과적으로 예방하여 국민의 삶의 질을 향상시킬 수 있다. 또한 국가적인 보건사회적인 비용(직접적 의료 비용, 노동손실)을 경감하고, 효과가 낮은 약제의 사용으로 인한 사회적 비용 낭비를 줄이고, 불필요한 약제부작용을 줄일 수 있는 사회적 파급효과가 있다. 앞으로 더욱 많은 연구자들, 임상의들, 정책입안자들의 관심과 노력을 기대한다.