From PGI
(Created page with "= '''약물반응과 관련 있는 암 유전자에서 NGS의 가능성''' = === 임상시각에서 본 NGS === 최근 시간과 비용을 획기적으...") |
|||
| Line 1: | Line 1: | ||
| − | |||
| − | + | = '''약물반응과 관련 있는 암 유전자에서 NGS의 가능성''' = | |
| − | |||
| − | |||
| − | + | === 임상시각에서 본 NGS === | |
| − | |||
| − | |||
| − | + | 최근 시간과 비용을 획기적으로 줄인 게놈기술의 향상으로 인해 암 임상실습에서 게놈 프로파일링을 위한 방법으로 NGS에 대한 관심이 커져가고 있는 상황이다. 그러나 일반적으로 사용되는 유전자 지노타이핑 방법과 비교하였을 때 NGS만의 장점이 아직까진 부각되고 있지 않다. 본 연구에서는 임상적 게놈 프로파일링을 위한 NGS 가능성을 확인해보고 이에따른 개인형 맞춤 치료의 결과를 제시하고 있다. | |
| − | |||
| − | |||
| − | + | === 연구디자인 === | |
| − | |||
| − | |||
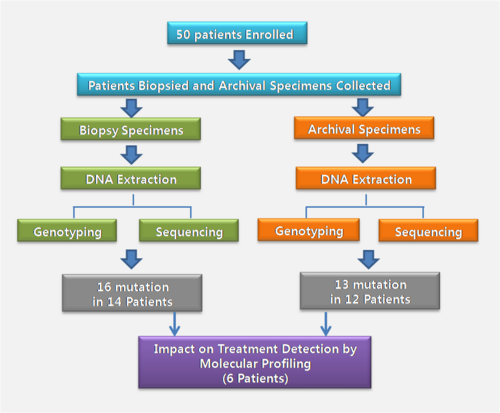
| − | + | [[File:GT NGS 201304 01.png|center|500px|GT NGS 201304 01.png]] | |
| − | + | 연구를 위해 캐나다에 있는 4개의 병원에서 50명의 환자를 선별하였고 이들에서 생검 조직과 파라핀블럭 견본을 모았다. 각각에서 DNA를 추출한 후, 지노타이핑과 NGS 엑솜시퀀싱을 수행하였다. 수행한 결과는 검증을 한 후 임상의사에게 전달되었고 임상의사에 의해 리뷰된 후 환자에게 검사결과를 알려주고 이에 맞는 치료방법을 고안하였다. 환자동의에서부터 검사결과가 나오기까지 평균 약 22일정도 걸린다고 하였으나 생검 조직의 재 획득, 분자적 분석의 지연, 전문가 암 패널 결과보고 지연 등으로 인해 더 지연되었다. | |
| − | |||
| − | |||
| − | + | === 분석결과 === | |
| − | |||
| − | |||
| − | + | 생검조직에서 지노타이핑은 86%, NGS 시쿼싱은 84%가 성공적으로 수행되었고 파라핀블럭견본에서는 지노타이핑 80%, NGS 시쿼싱은 74%가 수행되었다. 지노타이핑에서 탐지된 돌연변이외에 5개의 돌연변이가 NSG에 의해 추가 발견되었다. 이를 확인해본 결과, 2개는 기존에 알려진 돌연변이 였으며 3개는 기존 데이터베이스와는 다른 곳에서 발생된 돌연변이였다. | |
| − | |||
| − | |||
| − | + | 또한, 생검조직과 파라핀블럭 견본을 모두 가진 환자는 34명에서 지노타이핑과 NGS에 의해 탐지된 공통 돌연변이를 가진 경우는 30명(88%)이였다. 이는 암의 진전에 따른 돌연변이가 확장될것이라는 또다른 이슈에는 동의하지않는 결과였다. 왜냐하면 파라핀블럭 견본와 생검조직 채취와의 시간차이는 평균 33개월로 생검조직을 얻을때에는 질병의 진행이 좀더 이루어진 후였기 때문이다. | |
| − | |||
| − | |||
| − | + | 그럼에도 불구하고 두 조직간에 돌연변이 차이점은 거의 없었다. 이것은 암이 진행됨에 따라 돌연변이가 추가적으로 확장되지 않는다는 것을 의미하는 것이다. 각 환자에서 돌연변이를 분석한 이후 6명의 환자를 선별하여 개인 맞춤형 항암제 및 치료계획을 수립하고 환자를 치료하였다. 치료결과, 일부에서는 질병이 더 악화되었으나 일부에서는 증상이 호전되는 등 부분적인 치료효과를 보였다. | |
| − | |||
| − | + | ||
| + | === 맺음말 === | ||
| + | |||
| + | |||
| + | |||
| + | 본 연구는 임상에서의 NGS 활용 가능성을 본 실험으로써 NGS를 이용한 게놈 프로파일링을 하였으며 이를 근거로 하여 환자 별 맞춤형 치료까지 수행하였다. 그러나 methylation, 발현, copy수 변화, 단백질 결합 또는 재배열 등 다른 돌연변이 형태나 다른 엑손에서의 돌연변이 등을 탐지할 수는 없었다는 한계가 있다. 또한, 적은 수의 환자나 짧은 follow-up 등은 임상적 접근가치에 제한적이였다. 따라서 향후 많은 수의 환자와 긴 사후추적, 빠른 NGS를 이용한 프로파일링에 대한 가능성 연구를 추가로 수행하여야 될 것이다. | ||
| + | |||
| + | |||
| + | |||
| + | === 참고문헌 === | ||
| + | |||
| + | |||
| + | |||
| + | 1. Hudson TJ, Anderson W, Artez A, et al.International network of cancer genome projects. Nature 2010;464:993–8. | ||
| + | |||
| + | 2. Arcila M, Lau C, Nafa K, Ladanyi M. Detection of KRAS and BRAF mutations in colorectal carcinoma roles for high-sensitivity locked nucleic acid-PCR sequencing and broad-spectrum mass spectrometry genotyping. J Mol Diagn 2011;13:64–73. | ||
| + | |||
| + | 3. Beadling C, Heinrich MC, Warrick A, et al. Multiplex mutation screening by mass spectrometry evaluation of 820 cases from a personalized cancer medicine registry. J Mol Diagn 2011;13:504–13. | ||
Latest revision as of 08:29, 12 October 2022
약물반응과 관련 있는 암 유전자에서 NGS의 가능성
임상시각에서 본 NGS
최근 시간과 비용을 획기적으로 줄인 게놈기술의 향상으로 인해 암 임상실습에서 게놈 프로파일링을 위한 방법으로 NGS에 대한 관심이 커져가고 있는 상황이다. 그러나 일반적으로 사용되는 유전자 지노타이핑 방법과 비교하였을 때 NGS만의 장점이 아직까진 부각되고 있지 않다. 본 연구에서는 임상적 게놈 프로파일링을 위한 NGS 가능성을 확인해보고 이에따른 개인형 맞춤 치료의 결과를 제시하고 있다.
연구디자인
연구를 위해 캐나다에 있는 4개의 병원에서 50명의 환자를 선별하였고 이들에서 생검 조직과 파라핀블럭 견본을 모았다. 각각에서 DNA를 추출한 후, 지노타이핑과 NGS 엑솜시퀀싱을 수행하였다. 수행한 결과는 검증을 한 후 임상의사에게 전달되었고 임상의사에 의해 리뷰된 후 환자에게 검사결과를 알려주고 이에 맞는 치료방법을 고안하였다. 환자동의에서부터 검사결과가 나오기까지 평균 약 22일정도 걸린다고 하였으나 생검 조직의 재 획득, 분자적 분석의 지연, 전문가 암 패널 결과보고 지연 등으로 인해 더 지연되었다.
분석결과
생검조직에서 지노타이핑은 86%, NGS 시쿼싱은 84%가 성공적으로 수행되었고 파라핀블럭견본에서는 지노타이핑 80%, NGS 시쿼싱은 74%가 수행되었다. 지노타이핑에서 탐지된 돌연변이외에 5개의 돌연변이가 NSG에 의해 추가 발견되었다. 이를 확인해본 결과, 2개는 기존에 알려진 돌연변이 였으며 3개는 기존 데이터베이스와는 다른 곳에서 발생된 돌연변이였다.
또한, 생검조직과 파라핀블럭 견본을 모두 가진 환자는 34명에서 지노타이핑과 NGS에 의해 탐지된 공통 돌연변이를 가진 경우는 30명(88%)이였다. 이는 암의 진전에 따른 돌연변이가 확장될것이라는 또다른 이슈에는 동의하지않는 결과였다. 왜냐하면 파라핀블럭 견본와 생검조직 채취와의 시간차이는 평균 33개월로 생검조직을 얻을때에는 질병의 진행이 좀더 이루어진 후였기 때문이다.
그럼에도 불구하고 두 조직간에 돌연변이 차이점은 거의 없었다. 이것은 암이 진행됨에 따라 돌연변이가 추가적으로 확장되지 않는다는 것을 의미하는 것이다. 각 환자에서 돌연변이를 분석한 이후 6명의 환자를 선별하여 개인 맞춤형 항암제 및 치료계획을 수립하고 환자를 치료하였다. 치료결과, 일부에서는 질병이 더 악화되었으나 일부에서는 증상이 호전되는 등 부분적인 치료효과를 보였다.
맺음말
본 연구는 임상에서의 NGS 활용 가능성을 본 실험으로써 NGS를 이용한 게놈 프로파일링을 하였으며 이를 근거로 하여 환자 별 맞춤형 치료까지 수행하였다. 그러나 methylation, 발현, copy수 변화, 단백질 결합 또는 재배열 등 다른 돌연변이 형태나 다른 엑손에서의 돌연변이 등을 탐지할 수는 없었다는 한계가 있다. 또한, 적은 수의 환자나 짧은 follow-up 등은 임상적 접근가치에 제한적이였다. 따라서 향후 많은 수의 환자와 긴 사후추적, 빠른 NGS를 이용한 프로파일링에 대한 가능성 연구를 추가로 수행하여야 될 것이다.
참고문헌
1. Hudson TJ, Anderson W, Artez A, et al.International network of cancer genome projects. Nature 2010;464:993–8.
2. Arcila M, Lau C, Nafa K, Ladanyi M. Detection of KRAS and BRAF mutations in colorectal carcinoma roles for high-sensitivity locked nucleic acid-PCR sequencing and broad-spectrum mass spectrometry genotyping. J Mol Diagn 2011;13:64–73.
3. Beadling C, Heinrich MC, Warrick A, et al. Multiplex mutation screening by mass spectrometry evaluation of 820 cases from a personalized cancer medicine registry. J Mol Diagn 2011;13:504–13.