From PGI
Contents
CLDN2 유전자 변화로 나타난 췌장암
소화 불량과 복통, 구토 등의 증상이 있을 때, 가장 먼저 떠올리는 신체부위는 일반적으로 위라고 생각하기 쉽다. 그러나 이와 비슷한 증상인데도 우리가 잘 떠올리지 못하는 복병이 췌장이다. 췌장의 존재를 간과했다가는 무서운 결과를 초래할 수 있다. 췌장암(pancreatic cancer)은 평소 건강하게 지내던 사람이라도 갑자기 체중이 빠지고 통증이 생겨, 병원을 뒤늦게 찾았다가 검사 결과, 수술도 할 수 없는 경우가 대부분이다. 우리나라의 췌장암 발생률은 9위이지만, 췌장암 상망률은 5위를 차지 할 정도로 예후가 나쁜 종양이다. 특히 10년 전에 비해 발생빈도가 2배 이상 증가했고 앞으로도 계속 증가할 것으로 예상된다.
췌장암의 주요 원인으로는 환자측 요인과 환경적 요인으로 나눌 수 있다. 환자측 요인으로는 유전적 소인과 당뇨병, 췌장염, 나이 등이 있고, 환경적 요인은 흡연, 음주, 식이습관 등이 있다. 이 중 대부분 과도한 알코올 섭취에 의한 췌장암으로 인식하고 있으나, 유전적 소인을 무시할 수 없다. 실제 한 연구 결과에서는, 성인에서 발병하는 만성 췌장암의 주요 위험 요인으로 과도한 알코올 섭취로 알려져 있으나, 알코올은 불과 3% 밖에 영향을 미치지 않고, 다른 요인에 의한 원인이 크다고 한다.
췌장암 유전체 분석
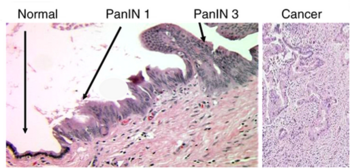
그림 1 췌장암 소핵 모델
췌장은 외분비와 내분비를 모두 수행하는 기관으로, 반복적인 급성 췌장암 환자는 내분비 선의 손상으로 인해 외분비 선의 위축과 통증을 유발하게 되는 것이다. 이번 연구는 환경적 요인은 같지만 유전적 소인이 달라서 생기는 다양한 임상 표현형을 구별하여 진행되었다.
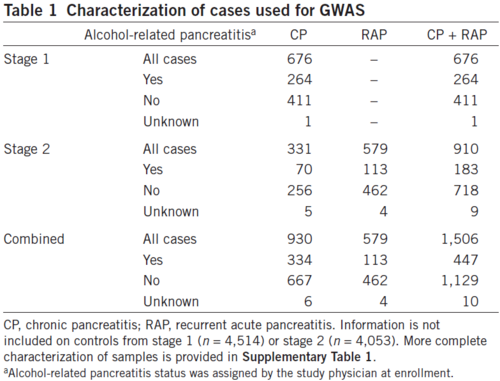
표 1 GWAS에 이용된 환자 특징
췌장암의 알코올 섭취와의 연관성과 유전적 변이에 의한 것이라면 어떠한 유전자가 관련되어 있는지 알아보기 위해, 피츠버그 의과대학의 소화기내과 연구소에서는 1,000명의 재발성 급성 췌장암과 만성 췌장암 환자, 북미 췌장암 연구(NAPS) 프로젝트에서 환자 및 임상 데이터를 수집하여, 췌장암 1기(case 676), 2기(case 910(만성 311명, 급성 579명)) 환자들과 건강한 사람 4,514명의 GWAS(Genome wide association study)를 수행하였다. [표 1]은 GWAS에 이용된 환자의 알코올 관련 특징이다. 또 [표 1]의 1단계는 새로운 위험 loci 발견에 초점을 맞추고 진행하였으며, 2단계는 세 가지 유전자에 초점을 맞추고 진행하였다.
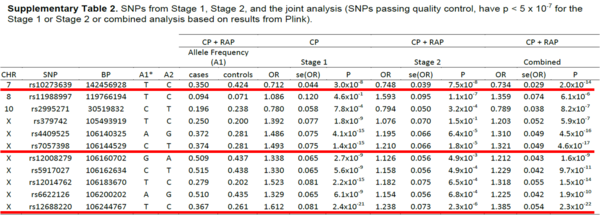
표 2 1단계와 2단계에서 chr변이 비교
표 3 만성/급성 췌장암에서 특정 loci 비교
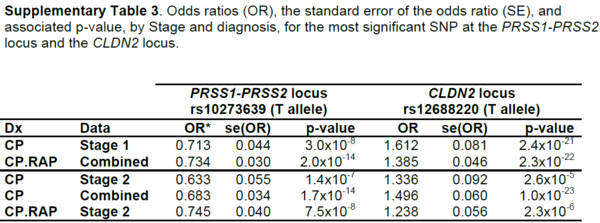
[표 2]는 췌장암 1, 2단계에서 염색체 변이를 비교한 것이고, [표 3]은 만성 및 급성 췌장암에 특정 loci의 유전자 변이를 확인한 것이다.
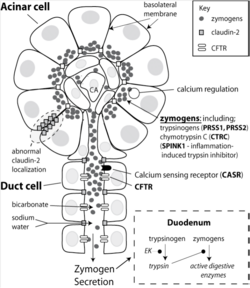
[표 2]와 [표 3]의 분석은 유럽인 만성 췌장암 환자 676명과 건강한 4,507명을 Illumina HumanOmni1_Quad_V1-0_B 칩으로 지노타이핑(genotyping)하여 SNP 625,739개에 대해 분석이 실시되어, 염색체 내 2개의 loci에서 유전자 변이가 발견된 것이다.Xq23.3 영역에서 CLDN2, 7q34 영역에서 PRSS1, PRSS2 유전자 변이가 확인되었는데, 변이가 발견된 유전자들의 특징은 다음과 같다. CLDN2 유전자는 claudin-2 단백질을 암호화하고, PRSS1는 양이온 트립시노젠(trypsinogen)을 암호화하며, PRSS2는 음이온 트립시노젠(trypsinogen)을 암호화하는 유전자이다.
세 가지 유전자의 위험도
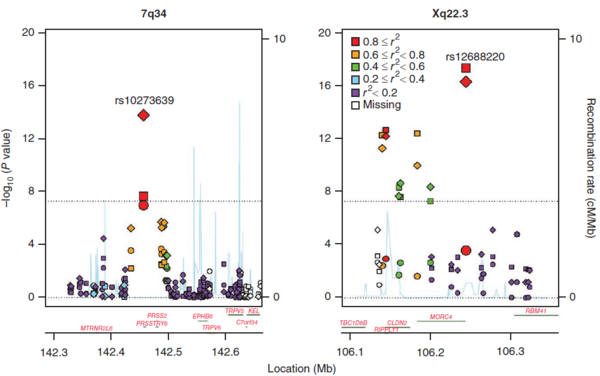
그림 2 급성 및 만성 췌장암에 관련된 지역의 Manhattan plot
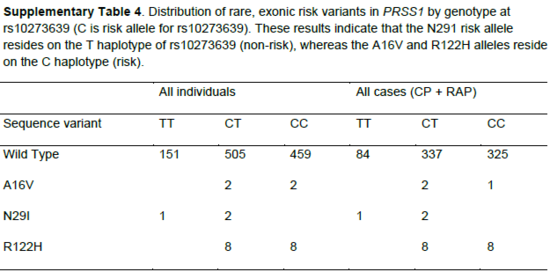
췌장암에 관련된 PRSS1, PRSS2, CLDN2 유전자는 각각 p.Ala16Val, p.Asn29Ile, p.Arg122His 변이를 유발한다. PRSS1 유전자는 rs10273639가 PRSS1 유전자의 5’ 프라이머에 위치한다. 이는 기능을 획득하는 돌연변이인데, 급성 및 만성 췌장암을 모두 증가시키는 희귀한 특징을 가지며, rs10273639로 인해 췌장암의 위험에 직접적인 영향을 미치는 것으로 추측된다. 반면, PRSS2 유전자의 경우 반대로 기능이 손실되는 돌연변이인데, PRSS1과 마찬가지로 급성 및 만성 췌장암을 모두 증가시킨다.
CLDN2 유전자는 X 염색체에 위치하는 췌장암의 주요 후보 유전자로서, Claudin-2 단백질을 발현시킨다. Claudin-2 단백질은 저항성이 낮고, 내피 세포 사이의 H2O 채널의 양이온 선택 조절력이 높다. 또한 CLDN2 유전자의 프로모터는 NF-κB 결합 부위를 포함하는데, 부상이나 스트레스와 관련된 반응에서 claudin-2를 발현시키는 역할을 한다.
췌장암 위험을 증가시키는 무엇
표 4 PRSS1 의 C allele가 위험
[표 4]는 rs10273639에서 3가지(CLDN2, PRSS1, PRSS2) 위치의 69개 췌장 조직 샘플을 지노타이핑하여 발견한 PRSS1 유전자의 위험 변이를 보여준다. rs10273639에서 C의 대립유전자가 있으면 위험하다는 것을 보여주는데, A16V와 R122H는 한 가닥이 C로 위험도가 높은 것을 볼 수 있다. 이로 인해 트립시노젠(Trypsinogen)의 발현량이 감소하게 되어, 췌장을 보호하지 못하게 된다. 또한 남성이 여성보다 더 높은 위험도를 가지는데, 여성의 경우 0.07이지만, 남성은 반접합체라서 0.26으로 높은 위험도를 나타내었다. 또 CLDN2 유전자는 대립유전자가 같아 더욱 위험하며, 알코올 섭취 시 위험이 증폭되는 경향을 보인다.
CLDN2 유전자 변이
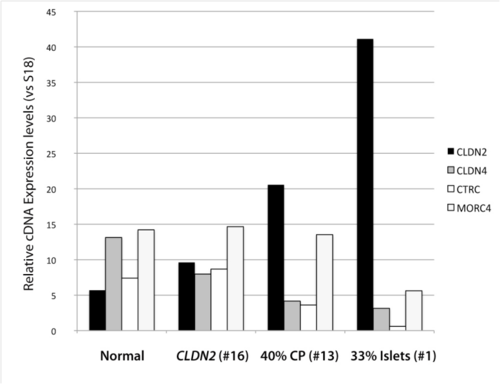
그림 3 컨트롤 조직에서 CLDN2, CLDN4, CTRC, MORC4의 과발현
CLDN2 유전자가 있는 염색체에는 MORC4, RIPPLY1. TBC1D8B 단백질이 같이 발현된다. MORC4는 태반과 고환에서 높은 발현을 보이는 유전자로, 시스테인에 아연이 결합하여 발현되는 MORC4 단백질을 전사한다. 시스테인에 아연이 결합하는 CLDN2, CLDN4, CTRC, MORC4 유전자의 발현 단백질들이 nuclear localization, nuclear matrix 결합 도메인을 포함하는데, 특히 CLDN2 유전자의 발현이 많으며, MORC4 유전자의 발현이 적다. RIPPLY1과 TBC1D8B은 췌장에서 발현이 되지 않는다.
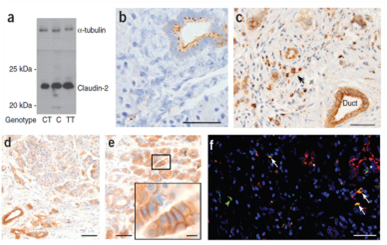
그림 4 rs12688220 사람 췌장암에서 claudin-2 발현 localization
[그림 4]의 a는 CLDN2 유전자 변이로 인해, claudin-2 항체가 있는 조직에서 추출된 단백질을 plot 분석한 것이다. 적절한 크기의 하나의 단백질 밴드를 발견하여 조직의 염증 반응과 관련 있는 발현을 한다는 사실을 발견하였다. rs12688220 변이로 인해, 인간의 췌장암에서 claudin-2가 발현되는 것을 볼 수 있는데, [그림 4]의 b는 쥐 모델에서 claudin-2 항체를 사용하여 염색한 것이다. [그림 4]의 c와 d는 각각 T와 C의 대립유전자 위험도가 높은 만성 췌장암의 관과 소핵을 보여주며, e는 세포 벽의 만성 췌장암 조직의 높은 위험의 유전형 케이스를 보여준다. [그림 4]의 f는 면역형광법 염색에서 claudin-2는 빨간색, 췌장관의 CD68 마커는 녹색, 동일 위치에 있는 세포는 노란색, Hoechst 염색은 파란색으로 보인다.
췌장암과 알코올은 관련 없다
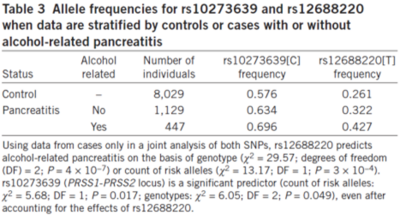
표 5 rs10273639와 rs12688220 대립유전자 빈도
[표 5]는 췌장암이 알코올과 관련성 여부에 근거하여 지노타이핑 결과를 비교한 것이다. 췌장암과 알코올 섭취는 관련성이 없다고 확인된 것이며, rs10273639, rs12688220의 대립유전자 빈도를 확인하여, 두 loci의 효과는 알코올 소비에 의해 증폭될 수는 있으나, 직접적인 영향력은 없다고 나왔다. 췌장암 환자 중에도 CLDN2 유전자 변이를 가진 사람이 알코올 소비에 따른 췌장암의 민감도가 높게 나왔으나, CLDN2 변이로 인해 급성에서 만성으로의 전환을 가속화 할 뿐이다. 췌장암의 위험도가 높은 것은 대립유전자가 아닌 트립신에 의해 프로세스를 조절하여 위험을 줄일 수 있다.
맺음말
본 연구에서는 CLDN2 유전자의 변이로 인해 췌장암의 알코올과의 연관성과 위험성 대립유전자를 확인하였다.
췌장암은 스티븐잡스의 병으로 더욱 유명해진 암이다. 초기에 증상이 거의 없어서 병이 많이 진행된 후 발견이 되는데, 늦은 발견으로 인해 손을 쓸 수 있는 시기를 놓지는 경우가 허다하다. 또한 췌장암은 원인이 명확히 밝혀지지 않아 다른 암에 비해 전체 단계의 증상이 뚜렷하지 않다. 그런데 췌장암의 경우, 5~10%의 유전 비율을 가지고 있으며, 가족력이 있으면 8% 정도 유전이 된다고 한다. 일반인이 0.6%인데 비해 가족력이 있으면, 13배 이상 위험도가 높아지는 것이다. 췌장암의 유전체 해독이 중요한 이유는 이처럼 유전 비율이 높으며, 가족력에 따라 바뀔 수 있는 치료형태 때문이다.
참고문헌
Common genetic variants in the CLDN2 and PRSS1-PRSS2 loci alter risk for alcohol-related and sporadic pancreatitis
http://www.nature.com/ng/journal/v44/n12/full/ng.2466.html
What is personalized medicine and what should it replace?
http://www.ncbi.nlm.nih.gov/pubmed/22614753
Whole exome sequencing identifies multiple, complex etiologies in an idiopathic hereditary pancreatitis kindred.
http://www.ncbi.nlm.nih.gov/pubmed/22572128
저자
글 : Park.HyeonJi
편집 : Lee.SeungYoun
키워드 : 췌장암(pancreatic cancer), GWAS(Genome wide association study), 지노타이핑(genotyping), CLDN2, PRSS1, PRSS2, claudin-2 , trypsinogen , rs10273639, rs12688220, MORC4 등